Atenção
Fechar
A passividade dos aços resistentes à corrosão depende essencialmente do seguintes fatores: a)- composição química; b)- condições de oxidação; c)- suscetibilidade à corrosão localizada (“pitting”); d)- suscetibilidade à corrosão intergranular; e)- outros.
4.1 – Composição química
O cromo, como foi visto, é o elemento mais importante; um teor mínimo de 10% é exigido para atingir a necessária passividade que é, por assim dizer, completa com 20% a 30% de cromo.
O níquel segue ao cromo em importância; sua atuação faz-se sentir não só na melhora da resistência à corrosão dos aços inoxidáveis ao cromo em soluções neutras de cloreto e em ácidos de baixa capacidade de oxidação, como igualmente no sentido de melhorar suas propriedades mecânicas. Essa influência é particularmente grande quando o teor de níquel é superior a 6% ou 7%.
Na realidade, os aços inoxidáveis contendo simultaneamente cromo e níquel, chamados austeníticos, constituem os melhores tipos de aços resistentes à corrosão. O carbono, forçosamente presente em todos os tipos de aços, diminui ligeiramente a corrosão dos aços inoxidáveis ao cromo-níquel quando precipitado na forma de carbonetos nos contornos dos grãos. O molibdênio geralmente aumenta a passividade e a resistência à corrosão nos ácidos sulfúrico e sulfuroso a altas temperaturas e pressão e em soluções neutras de cloreto, particularmente na água do mar. O cobre é, às vezes, adicionado nos aços inoxidáveis para melhorar sua resistência à corrosão em certos reagentes, entre os quais o ácido sulfúrico. Da mesma maneira atua o silício, cujo efeito principal, entretanto, é no sentido de melhorar a resistência à oxidação a temperaturas elevadas. O manganês só é levado em conta como produzindo efeitos acentuados quando é usado para substituir o níquel. O tântalo e o nióbio são às vezes adicionados, sobretudo nos aços inoxidáveis cromo-níquel, devido à sua grande avidez pelo carbono, evitando que se produza um dos tipos mais nocivos de corrosão – a “corrosão intergranular”. O nitrogênio também tem sido adicionado em aços ao cromo onde há pequenas quantidades de níquel, (0,5 a 1,0% para melhorar a trabalhabilidade), níquel esse que pode ser substituído por nitrogênio; do mesmo modo, pequenas quantidades de nitrogênio podem ser introduzidas nos aços com 0,3 a 0,4% de carbono e 14,0% de cromo, para melhorar sua dureza, sem prejudicar sua resistência à corrosão ( o que ocorreria aumentando-se o teor de carbono). O nitrogênio, em aços com 16 a 19% de cromo e baixo carbono, melhora sua soldabilidade e a sua resistência à corrosão intercristalina. Finalmente, em aços cromo-níquel e cromo-manganês, o nitrogênio melhora a estabilidade da austenita, em relação à temperatura de trabalho a frio, resultando numa economia de níquel.
4.2 – Condições de oxidação
É evidente que a velocidade e a extensão do ataque dependem da capacidade oxidante do meio circundante. Nesse sentido, podem se classificar todos os meios corrosivos, quer líquidos, quer gasosos, em dois grupos: oxidantes, que tendem a tornar passiva uma determinada liga; redutores, que tendem a tornar passiva uma determinada liga; redutores, que tendem a diminuir sua passividade.
Em relação aos ácidos fortes, pode-se verificar experimentalmente que a linha divisória entre os ácidos oxidantes e os redutores é representada pelo ácido sulfúrico. No lado oxidante encontra-se o ácido nítrico e no redutor o ácido clorídrico e o fluorídrico, entre outros. Assim sendo, o aço inoxidável que é perfeitamente empregado em meio oxidante como ácido nítrico, perde toda a sua utilidade quando em contato com ácidos redutores.
4.3 –Suscetibilidade à corrosão localizada (“pitting”)
Os aços inoxidáveis são suscetíveis de apresentarem um tipo de corrosão localizada somente em certos pontos da superfície e o ataque corrosivo, uma vez iniciado, progride principalmente em profundidade, chegando a ocasionar orifícios às vezes tão profundos que podem atravessar todo o metal. Esse tipo de corrosão é devido à ação do íon negativo cloro de soluções aquosas. São, pois, as soluções de cloreto que provocam mais freqüentemente a corrosão localizada nos aços inoxidáveis. Tal fato precisa ser lembrado ao se tentar utilizar os aços inoxidáveis em contato com qualquer concentração de ácido clorídrico, ou soluções de cloreto de ferro, cloreto de cobre, cloretos alcalinos e alcalino-terrosos. Assim sendo, até mesmo a atmosfera salina tende a prejudicar as excelentes qualidades de resistência à corrosão de muitos aços inoxidáveis.
A corrosão localizada pode ser, às vezes, mais prejudicial do que a corrosão generalizada, visto que cria pontos de concentração de tensões que levarão o metal à ruptura por fadiga. Certas adições de elementos de liga, especialmente o molibdênio, e outros meios têm sido usados para evitar a corrosão localizada. Entre esses outros meios, mencionam-se: um melhor acabamento da superfície metálica, um tratamento prévio, para aumentar a passividade, em um banho de ácido nítrico a quente com concentração 10-20%, tratamento térmico correto, etc.
4.4 – Suscetibilidade à corrosão intergranular
Os aços inoxidáveis cromo-níquel (tipos austeníticos) estão sujeitos, quando tratados termicamente ou aquecidos para trabalho a quente ou para soldagem numa certa faixa de temperaturas, a uma precipitação de um constituinte de contorno de grão que pode provocar um dos tipos mais danosos da corrosão, a chamada “corrosão intergranular”. A faixa de temperaturas críticas é 400 a 900 graus C, e quando o aço for aquecido dentro dessa faixa ainda que por um tempo muito curto (poucos minutos ou mesmo segundos) pode sofrer uma quase completa desintegração após algumas horas de exposição numa solução corrosiva. A temperatura que produz o fenômeno (chamado de “sensitization”) varia com o tempo de aquecimento; assim, por exemplo, num aço inoxidável do tipo 18-8 (18% de cromo e 8% de níquel) com 0,08% de carbono, com aquecimento de poucos segundos ou minutos, a temperatura mais perigosa é em torno de 750 graus C; com um tempo de aquecimento de uma hora, esta temperatura fica compreendida na faixa 550-740 graus C.
A explicação mais aceita do fenômeno é a seguinte:
- certos constituintes, principalmente um carboneto complexo de cromo e ferro, dissolvem-se na austenita com facilidade cada vez maior, à medida que a temperatura sobe além de 900 graus C. Um aço inoxidável aquecido nessas condições apresenta, quando resfriado rapidamente, uma estrutura homogênea à temperatura ambiente. Esse estado estrutural é, entretanto, instável em temperaturas inferiores à linha de solubilidade sólida do carbono na austenita (ver diagrama da figura 170 correspondente aos aços 18-8), de modo que quando se aquece o aço acima de 400 graus C, o carboneto, pelo aumento da solubilidade dos átomos de carbono, precipita-se e essa precipitação, mais acentuada na faixa entre 600-800 graus C, se dá ao longo dos contornos dos grãos.
Esses carbonetos, precipitados ao longo dos contornos dos grãos, não constituem em si zonas mais suscetíveis à corrosão, mas como eles são muito mais ricos em cromo (às vezes até 90%) que o metal do seio do qual precipitam, para sua formação houve uma retirada de cromo das regiões vizinhas. Essas regiões, que correspondem aos contornos dos grãos, empobrecem-se, portanto, em cromo, tornando-se menos resistentes ao ataque químico por parte de certos reagentes: produz-se assim a corrosão entre os grãos, provocando sua separação e conseqüente desintegração da liga.
Em face das explicações feitas a respeito do fenômeno da corrosão intergranular nos aços inoxidáveis do tipo austenítico, pode-se dizer que a suscetibilidade desses aços à corrosão intergranular depende de uma série de fatores, entre os quais poderiam ser enumerados os seguintes:
- tempo de permanência dentro da faixa de temperaturas consideradas críticas;
- teor de carbono;
- granulação do aço;
- deformação a frio;
- presença de determinados elementos de liga.
A discussão da influência desses fatores será feita concomitantemente com os meios que podem ser empregados para combater o fenômeno. Esses meios são, entre outros, os seguintes:
- Reaquecimento do aço, que havia sido anteriormente aquecido na faixa perigosa 400-800 graus C, a temperaturas entre 950 e 1150 graus C, de modo a ter-se uma redissolução dos carbonetos existentes nos contornos dos grãos. É preciso, para evitar sua nova precipitação, resfriar-se rapidamente através da faixa perigosa.
Esse reaquecimento nem sempre é conveniente, pois pode ocorrer oxidação e empenamento ou mesmo deformação das peças a essas temperaturas. Por outro lado, toda vez que for preciso reaquecer o aço dentro daquela faixa de temperaturas, devido a uma soldagem, por exemplo, pode ocorrer nova precipitação de carboneto com as conseqüências indesejáveis já conhecidas.
- Redução do teor de carbono do aço a teores que o tornem ineficaz na formação de carbonetos ou na remoção do cromo dos grãos. A figura 158 (229) ilustra de modo claro o efeito do carbono na resistência à corrosão do aço inoxidável austenítico tipo 18-8. Para o traçado da curva representada no gráfico, amostras de aço 18-8 com carbono crescente foram propositadamente aquecidas a temperaturas que provocaram, no maior grau possível, a precipitação de carboneto.
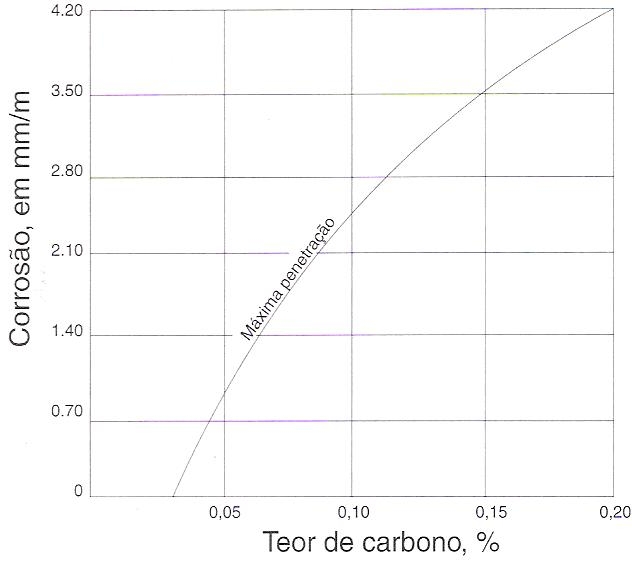
Fig. 158 – Efeito do teor de carbono sobre a corrosão de aço inoxidável 18-8 tratado termicamente de modo a produzir a máxima precipitação de carbonetos.
Nota-se que à medida que o carbono decresce, diminui o ataque corrosivo, o mínimo verificando-se quando o mesmo atinge 0,03%. Até 0,03% de carbono, qualquer que tenha sido o tratamento térmico usado, o carbono ou permanece dissolvido sem qualquer efeito nocivo, ou precipita-se nos contornos dos grãos na forma de um carboneto de cromo, em quantidades, entretanto, ainda insuficientes para formar um invólucro contínuo em torno dos grãos, de modo que não resulta qualquer prejuízo. Acima de 0,03%, o carboneto de cromo formado começa a envolver de modo contínuo os grãos, ocorrendo então o empobrecimento do metal adjacente a tal ponto que sua inoxibilidade fica prejudicada.
Estudos têm sido feitos para determinar o teor de carbono compatível com a resistência à corrosão intergranular. De um desses estudos resultou o traçado das linhas da figura 159 que mostra, para teores diversos de cromo e carbono, a probabilidade de corrosão intergranular. Verifica-se, por exemplo, que para uma probabilidade de 99,8% de resistência à corrosão intergranular, o teor de carbono deve ser inferior a 0,02% com 18% de cromo; aumentando-se o teor deste metal, o teor de carbono aumenta até cerca de 0,03%; para 20% de cromo, o aço ainda apresenta excelente resistência à corrosão intergranular, com cerca de 0,04% de carbono. Em resumo, normalmente para os aços 18-8 comuns o máximo recomendável de carbono seria em torno de 0,03%.
- Manter um tamanho de grão pequeno, pois a granulação grosseira torna o aço mais suscetível à corrosão intergranular que a granulação fina.
- Promover deformação a frio após a solubilização; admite-se, de fato, que a precipitação de carbonetos, responsável aparente pela corrosão intergranular, se dará preferivelmente ao longo dos planos de escorregamento originados na deformação a frio no interior dos grãos e não nos seus contornos, resultando uma dispersão dos carbonetos dentro dos grãos, o que diminuirá a suscetibilidade à corrosão intergranular. É necessário, após a deformação a frio, aquecer o aço dentro da faixa crítica para forçar a precipitação dos carbonetos ao longo dos planos de escorregamento.
- O método mais comum e mais satisfatório consiste na adição de um elemento de liga que tenha maior afinidade pelo carbono do que o cromo, evitando, pois, que este precipite como carboneto e deixando-o em condições de agir como elemento realmente promotor da passividade. Os elementos de liga empregados para esse fim são o titânio, o nióbio e o tântalo, os dois primeiros sendo os preferidos.
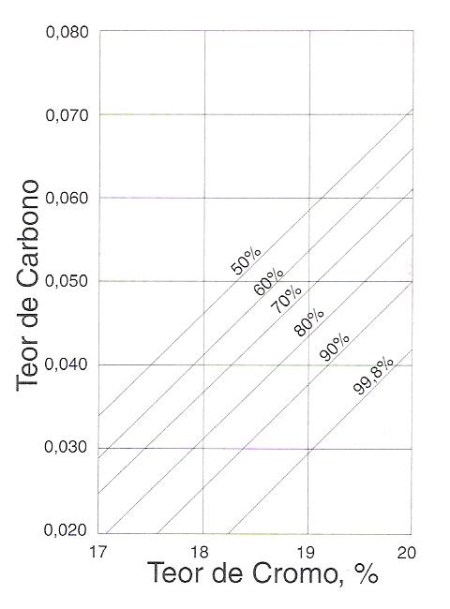
Fig. 159 - Probabilidade de corrosão intergranular em função dos teores de cromo e carbono.
Por outro lado, a presença de 1% a 3% de molibdênio torna o aço inoxidável austenítico menos susceptível à corrosão intergranular, pois, sendo o molibdênio um elemento estabilizador da ferrita, favorece a formação de estrutura austenítico-ferrita. Sua ação, entretanto, é somente no sentido de diminuir ligeiramente a suscetibilidade dos aços ao fenômeno em discussão.
4.5 – Outros fatores
A resistência à corrosão dos aços pode ainda ser afetada pelos seguintes fatores adicionais:
- condição da superfície – a probabilidade de corrosão é diminuída pela presença de superfícies macias, isenção de defeitos superficiais, isenção de casca de óxido e outras substâncias estranhas. Geralmente, pois, uma superfície muito polida apresenta maior resistência à corrosão, visto que superfícies grosseiras têm maior tendência de acumular poeiras, sais e umidade que podem provocar ataque corrosivo local;
- fissuras –formadas em juntas e conexões ou em pontos de contato entre o metal e substâncias não metálicas, são mais freqüentemente sujeitas a ataque. De fato, numa fissura, o suprimento de oxigênio é limitado e insuficiente para reparar a película passiva de óxido, se destruída. Aparece, então, a chamada “célula de concentração diferencial” ou “célula de corrosão”. Nessas fissuras pode-se acumular umidade do ar atmosférico ou da água do mar (com sais, portanto), criando condições mais propícias ao ataque corrosivo;
- fenômenos de natureza galvânica – Esses fenômenos se verificam na presença de um eletrólito (uma solução ácida, ou, no limite, a própria umidade atmosférica), quando dois elementos metálicos ficam ligados entre si diretamente com continuidade elétrica, formando uma verdadeira pilha. O elemento que sofre a corrosão mais rapidamente é o mais anódico. Por exemplo, um parafuso de aço comum numa chapa de aço inoxidável será rapidamente corroído porque o aço inoxidável atua como um catodo de grandes dimensões; ao contrário, um parafuso de aço inoxidável numa chapa de grandes dimensões se aço comum causará a corrosão desta, de modo relativamente lento: essa ação deve-se ao fato de que um pequeno anodo e um grande catodo originam um aumento da densidade de corrente do anodo, o que produz como conseqüência um aumento da velocidade de corrosão. A corrosão galvânica pode ocorrer num mesmo material metálico que, por apresentar falta de homogeneidade de composição química ou de fases estruturais e, em contato com o eletrólito, provoque a criação de zonas distintas anódicas e catódicas. Em resumo, não se aconselha, por exemplo, prender com pregos ou rebites de alumínio ou de aço-carbono, peças de aço inoxidável mergulhadas em ambientes corrosivos, porque o aço comum e o alumínio estão mais próximos da extremidade anódica da série galvânica. Do mesmo modo, não se aconselha juntar peças de aço inoxidável entre si ou com elementos nobres mediante soldagem ou brazagem pelo emprego de ligas anódicas (menos nobres).
- tensões – podem originar corrosão – denominada “corrosão sob tensão” (stress-corrosion) – levando a rupturas de peças em serviço. Esse tipo de corrosão nos aços inoxidáveis não é muito freqüente; entretanto, o fenômeno tem sido notado em soluções que contêm cloretos quando tensões elevadas (residuais ou aplicadas) estão presentes no aço inoxidável. As soluções tidas como agressivas são de cloreto de sódio, magnésio, cálcio, zinco e lítio. Dentre essas, uma solução fervente concentrada de cloreto de magnésio é muito agressiva e pode causar a ruptura de peças de aço inoxidável austenítico em pouco tempo (1/2 a 2 horas), se o aço estiver sob uma tensão próxima ao seu limite de escoamento. A fratura por “corrosão sob tensão” pode ser tanto intergranular como transgranular. Admite-se que os aços inoxidáveis ferríticos não estão sujeitos ao fenômeno de corrosão sob tensão provocada pela presença de soluções de cloretos. A incidência da “corrosão sob tensão” pode ser atenuada ou evitada desde que se procure preencher os seguintes requisitos: projeto adequado da peça, de modo a reduzir as tensões flutuantes, térmicas ou mecânicas; composição química adequada dos aços inoxidáveis (por exemplo, os aços inoxidáveis austeníticos contendo molibdênio são menos sujeitos ao fenômeno); tratamento térmico adequado, como recozimento final para alívio de tensões (entre 815 e 925 graus C), seguido de resfriamento ao ar ou em forno, confere imunidade à corrosão sob tensão; tratamentos mecânicos como por jacto-abrasivo ou jato de areia melhoram as condições de resistência do material a esse tipo de corrosão, pois introduzem tensões superficiais de compressão, contrabalançando as tensões de tração; tratamento químico, como decapagem, tornando a superfície menos sensível (do que uma superfície polida); evitar a soldagem entre aços austeníticos e aços-carbono ou ferríticos, em vista das tensões originadas pela diferença entre os coeficientes de dilatação durante o aquecimento e o resfriamento.
Como complemento das considerações até aqui feitas, podemos fazer as seguintes generalizações:
a) a resistência à corrosão depende da passividade;
b) o cromo é o elemento básico para conferir passividade dos aços;
c) condições fortemente redutoras, ou seja, ausência de condições oxidantes, causam suscetibilidade ao ataque corrosivo;
d) condições fortemente promovem extraordinária resistência ao ataque;
e) e íon cloro é destrutivo em relação aos aços-cromo;
f) o níquel, além de melhorar as propriedades mecânicas dos inoxidáveis, melhora sua resistência à corrosão em soluções neutras de cloretos e ácidos de baixa capacidade de oxidação;
g) o molibdênio aumenta a faixa de passividade dos aços inoxidáveis e melhora sua resistência à corrosão em ácidos sulfúrico e sulfuroso quentes, em soluções neutras de cloretos, como água do mar;
h) o ataque intergranular dos aços-níquel-cromo, fenômeno típico nesses tipos de aços inoxidáveis, é evitado por baixos teores de carbono, tratamento térmico adequado ou introdução de titânio e nióbio.